BMBF-Verbundprojekt: DNA-Reparaturfoci als Marker der individuellen Strahlenempfindlichkeit

Durch die zunehmende Nutzung ionisierender Strahlen in der Medizin ist die zivilisatorische Strahlenbelastung der Bevölkerung in den letzten Jahren deutlich gestiegen. Die Strahlendosen reichen dabei von wenigen mGy (bei beruflich oder radiodiagnostisch bedingten Expositionen) bis hin zu mehreren Gy (im Rahmen einer Radiotherapie). Bei gleicher physikalischer Dosis können die biologischen Effekte einer Strahlenexposition erheblich variieren, da große Unterschiede in der individuellen Strahlenempfindlichkeit existieren. Daher ist die Etablierung biologischer Marker für die Erfassung dieser individuellen Unterschiede dringend erforderlich. In der Strahlenbiologie erfolgt der Nachweis strahleninduzierter DNA Schäden als sog. Reparaturfoci mittels antikörperbasierter Immunfluoreszenz-Mikroskopie. Im Rahmen des Verbundprojektes werden spezifische DNA Reparaturfoci (RF) als biologische Marker der individuellen Strahlenempfindlichkeit für verschiedene Fragestellungen validiert.
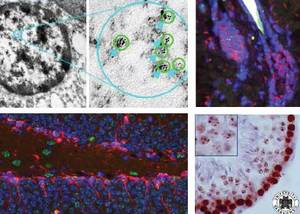
Die bisherigen Ergebnisse zeigen insgesamt, dass RF nicht isoliert, sondern grundsätzlich im Kontext des Chromatins beurteilt werden müssen. Die globale Chromatin-Konformation wird durch die spezifische Zellkern-Architektur bestimmt, und ist insbesondere vom Zelltyp und Differenzierungsstatus, sowie von der Zellzyklusphase abgängig. Die Packungsdichte des Chromatins kontrolliert die Zugänglichkeit des Genoms und bestimmt somit die funktionelle Aktivität der verschiedenen Genregionen. Dementsprechend werden die grundlegenden zellulären Prozesse wie Transkription, Replikation und Reparatur entscheidend durch die lokale Chromatin-Struktur beeinflusst. Einerseits besitzt die lokale Chromatin-Struktur einen essentiellen Einfluss auf die Reparaturmechanismen und Reparaturdynamiken; andererseits führen globale Umstrukturierungen der Chromatin Konformation nach Strahlenexposition über epigenetische Regulationsprozesse zu einer veränderten Genexpression und zu veränderten Zellfunktionen.
Im Rahmen dieses Verbundprojektes konnten hochauflösende Mikroskopie-Techniken etabliert werden, um strahleninduzierte DNA Schäden in der Ultrastruktur des Chromatins zu visualisieren. Hierdurch sind weitaus präzisere Analysen hinsichtlich der Prozessierung von DNA Schäden in den unterschiedlichen Chromatin-Kompartimenten möglich. Im Rahmen der laufenden Forschungsprojekte wird mithilfe dieser innovativen Techniken die pathophysiologische Bedeutung der RF für die Strahlenwirkung im unterschiedlichen biologischen Kontext charakterisiert.
Reference No. des BMBF: 02NUK035
Förderzeitraum ( 2014 - 2021)
BMBF-geförderte Publikationen:
Region-Specific Effects of Fractionated Low-Dose Versus Single-Dose Radiation on Hippocampal Neurogenesis and Neuroinflammation. Schmal Z, Rübe CE. Cancers (Basel). 2022 Nov 8;14(22):5477. doi: 10.3390/cancers14225477.PMID: 36428572
Histone Variant H2A.J Is Enriched in Luminal Epithelial Gland Cells. Redon CE, Schmal Z, Tewary G, Mangelinck A, Courbeyrette R, Thuret JY, Aladjem MI, Bonner WM, Rübe CE, Mann C. Genes (Basel). 2021 Oct 22;12(11):1665. doi: 10.3390/genes12111665.PMID: 34828271
Focused Ion Microbeam Irradiation Induces Clustering of DNA Double-Strand Breaks in Heterochromatin Visualized by Nanoscale-Resolution Electron Microscopy. Lorat Y, Reindl J, Isermann A, Rübe C, Friedl AA, Rübe CE. Int J Mol Sci. 2021 Jul 16;22(14):7638. doi: 10.3390/ijms22147638.PMID: 34299263
Fractionated Low-Dose Radiation Induces Long-Lasting Inflammatory Responses in the Hippocampal Stem Cell Niche. Schmal Z, Hammer B, Müller A, Rübe CE. Int J Radiat Oncol Biol Phys. 2021 Dec 1;111(5):1262-1275. doi: 10.1016/j.ijrobp.2021.07.007. Epub 2021 Jul 16.PMID: 34280471
Human skin aging is associated with increased expression of the histone variant H2A.J in the epidermis. Rübe CE, Bäumert C, Schuler N, Isermann A, Schmal Z, Glanemann M, Mann C, Scherthan H.NPJ Aging Mech Dis. 2021 Apr 1;7(1):7. doi: 10.1038/s41514-021-00060-z.PMID: 33795696
Analysis of chromosomal aberrations and γH2A.X foci to identify radiation-sensitive ataxia-telangiectasia patients. Bucher M, Endesfelder D, Roessler U, Borkhardt A, Dückers G, Kirlum HJ, Lankisch P, Oommen PT, Niehues T, Rübe CE, Baumgartner I, Bunk F, Moertl S, Hornhardt S, Gomolka M.Mutat Res Genet Toxicol Environ Mutagen. 2021 Jan-Feb;861-862:503301. doi: 10.1016/j.mrgentox.2020.503301. Epub 2020 Dec 10.PMID: 33551102
Histone Variant H2A.J Marks Persistent DNA Damage and Triggers the Secretory Phenotype in Radiation-Induced Senescence. Isermann A, Mann C, Rübe CE. Int J Mol Sci. 2020 Nov 30;21(23):9130. doi: 10.3390/ijms21239130.PMID: 33266246
Individual response of humans to ionising radiation: governing factors and importance for radiological protection. Applegate KE, Rühm W, Wojcik A, Bourguignon M, Brenner A, Hamasaki K, Imai T, Imaizumi M, Imaoka T, Kakinuma S, Kamada T, Nishimura N, Okonogi N, Ozasa K, Rübe CE, Sadakane A, Sakata R, Shimada Y, Yoshida K, Bouffler S.Radiat Environ Biophys. 2020 May;59(2):185-209. doi: 10.1007/s00411-020-00837-y. Epub 2020 Mar 7.PMID: 32146555 Review.
Assessment of DNA damage by 53PB1 and pKu70 detection in peripheral blood lymphocytes by immunofluorescence and high-resolution transmission electron microscopy. Lorat Y, Fleckenstein J, Görlinger P, Rübe C, Rübe CE. Strahlenther Onkol. 2020 Sep;196(9):821-833. doi: 10.1007/s00066-020-01576-1. Epub 2020 Jan 31.PMID: 32006067
DNA damage accumulation during fractionated low-dose radiation compromises hippocampal neurogenesis. Schmal Z, Isermann A, Hladik D, von Toerne C, Tapio S, Rübe CE. Radiother Oncol. 2019 Aug;137:45-54. doi: 10.1016/j.radonc.2019.04.021. Epub 2019 May 4. PMID: 31063923
Clustered DNA damage concentrated in particle trajectories causes persistent large-scale rearrangements in chromatin architecture. Timm S, Lorat Y, Jakob B, Taucher-Scholz G, Rübe CE. Radiother Oncol. 2018 Dec;129(3):600-610. doi: 10.1016/j.radonc.2018.07.003. Epub 2018 Jul 23.PMID: 30049456
Increasing genomic instability during cancer therapy in a patient with Li-Fraumeni syndrome. Schuler N, Palm J, Schmitz S, Lorat Y, Rübe CE. Clin Transl Radiat Oncol. 2017 Nov 2;7:71-78. doi: 10.1016/j.ctro.2017.10.004. eCollection 2017 Dec.PMID: 29594232
Hair Follicle Stem Cell Faith Is Dependent on Chromatin Remodeling Capacity Following Low-Dose Radiation. Schuler N, Timm S, Rübe CE. Stem Cells. 2018 Apr;36(4):574-588. doi: 10.1002/stem.2768. Epub 2018 Jan 12.PMID: 29282803
Histone variant H2A.J accumulates in senescent cells and promotes inflammatory gene expression. Contrepois K, Coudereau C, Benayoun BA, Schuler N, Roux PF, Bischof O, Courbeyrette R, Carvalho C, Thuret JY, Ma Z, Derbois C, Nevers MC, Volland H, Redon CE, Bonner WM, Deleuze JF, Wiel C, Bernard D, Snyder MP, Rübe CE, Olaso R, Fenaille F, Mann C.Nat Commun. 2017 May 10;8:14995. doi: 10.1038/ncomms14995.PMID: 28489069
Ultrastructural Insights into the Biological Significance of Persisting DNA Damage Foci after Low Doses of Ionizing Radiation. Lorat Y, Schanz S, Rübe CE. Clin Cancer Res. 2016 Nov 1;22(21):5300-5311. doi: 10.1158/1078-0432.CCR-15-3081. Epub 2016 May 19.PMID: 27199493
Clustered double-strand breaks in heterochromatin perturb DNA repair after high linear energy transfer irradiation. Lorat Y, Timm S, Jakob B, Taucher-Scholz G, Rübe CE. Radiother Oncol. 2016 Oct;121(1):154-161. doi: 10.1016/j.radonc.2016.08.028. Epub 2016 Sep 13.PMID: 27637859
Persistent DNA Damage in Spermatogonial Stem Cells After Fractionated Low-Dose Irradiation of Testicular Tissue. Grewenig A, Schuler N, Rübe CE. Int J Radiat Oncol Biol Phys. 2015 Aug 1;92(5):1123-1131. doi: 10.1016/j.ijrobp.2015.04.033. Epub 2015 Apr 25.PMID: 26059351
Nanoscale analysis of clustered DNA damage after high-LET irradiation by quantitative electron microscopy--the heavy burden to repair. Lorat Y, Brunner CU, Schanz S, Jakob B, Taucher-Scholz G, Rübe CE.DNA Repair (Amst). 2015 Apr;28:93-106. doi: 10.1016/j.dnarep.2015.01.007. Epub 2015 Jan 28.PMID: 25659339
Even low doses of radiation lead to DNA damage accumulation in lung tissue according to the genetically-defined DNA repair capacity. Flockerzi E, Schanz S, Rübe CE.Radiother Oncol. 2014 May;111(2):212-8. doi: 10.1016/j.radonc.2014.03.011. Epub 2014 Apr 17.PMID: 24746565
DNA-damage foci to detect and characterize DNA repair alterations in children treated for pediatric malignancies. Schuler N, Palm J, Kaiser M, Betten D, Furtwängler R, Rübe C, Graf N, Rübe CE. PLoS One. 2014 Mar 17;9(3):e91319. doi: 10.1371/journal. pone.0091319. eCollection 2014.PMID: 24637877
Kontakt

Koordinator
Prof. Dr. med. Claudia E. Rübe
Universitätsklinikum des Saarlandes
Kirrberger Straße
Gebäude 6.5
D-66421 Homburg/Saar
Tel.: 06841/16-34614
Fax: 06841/16-21401




