Arbeitsgebiet
Die Proteinkinase CK2 – ein Überblick
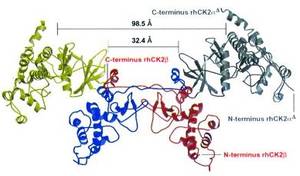
Abb.: Raumstruktur der Proteinkinase CK2 (aus Niefind K, et al.: Crystal structure of human protein kinase CK2: insights into basic properties of the CK2 holoenzyme. EMBO J. 2001;20(19):5320-31.)
Die Proteinkinase CK2 ist vor etwa einem halben Jahrhundert als Caseinkinase 2 entdeckt worden. Aufgrund ihrer möglichen Beteiligung an einer Reihe zellulärer Prozesse, insbesondere an der Regulation der Zellproliferation und der Apoptose hat sie in den letzten 25 Jahren steigende Beachtung auch und vor allem in der Tumorforschung erfahren. Die Proteinkinase CK2 ist ein hochkonserviertes Enzym, das sich durch eine hohe Homologie zwischen den Spezies auszeichnet. Die Kinase besteht aus zwei katalytischen (alpha, alpha’) und zwei regulatorischen (beta) Untereinheiten, die ein alpha2/beta2-, alpha/alpha’/beta2 oder ein alpha’2/beta2-Heterotetramer bilden. Dabei sind die alpha-Untereinheiten über die regulatorischen beta-Untereinheiten miteinander verbunden. Obwohl die beiden katalytischen CK2 Untereinheiten, CK2alpha und alpha’, eine sehr hohe Homologie aufweisen und sich nur in einigen wenigen C-terminalen Aminosäuren unterscheiden, sind sie in ihren Eigenschaften z.T. sehr verschieden. Ein Verlust von CK2alpha’ ist mit dem Leben der Zelle vereinbar, aber es treten Zellveränderungen z.B. bei der Spermatogenese auf. Ein Verlust von CK2alpha scheint dagegen nicht mit dem Leben einer Zelle vereinbar. Darüber hinaus findet man eine unterschiedliche Expression der beiden katalytischen Untereinheiten in verschiedenen Geweben. Die molekulare Basis für die unterschiedlichen Eigenschaften von CK2alpha und CK2alpha’ sind bislang nicht verstanden. Die Proteinkinase CK2 ist in cytosolischen und nucleären Kompartimenten lokalisiert und phosphoryliert dort eine Fülle von Substraten, die einen Hinweis auf ihre multiplen Funktionen in der Zelle geben können. CK2 ist eine Ser/Thr Kinase, die mit Vorliebe saure Proteinsubstrate an der Konsensussequenz S/TxxD/E phosphoryliert. Neben dem Holoenzym kann auch die katalytische Untereinheit alleine bestimmte Substrate phosphorylieren. Die vielfältigen Substrate (bislang etwa 400) lassen sich gruppieren in Proteine für Nukleinsäuresynthese und -reparatur (z.B. DNA Topoisomerasen I und II), Transkriptionsfaktoren inklusive Oncogenprodukte und Wachstumssuppressorproteine (z.B. c-myc, p53), Faktoren für die Proteinsynthese (eIF1b), Proteine der Signaltransduktion (p34cdc2, PKC), sowie virale Proteine.
Die zelluläre Regulation der CK2 ist nach wie vor schlecht verstanden. Aus der Kristallstruktur lässt sich ableiten, dass die CK2 konstitutiv aktiv ist, und damit die bekannten Regulationsmodi für Kinasen nicht greifen können. Da sie jedoch offensichtlich in mehrere Signaltransduktionswege wie den wnt- oder den MAP- Kinase-Signalweg eingebunden ist, die nicht ständig aktiv sind, ist eine Regulierbarkeit des Enzyms zu fordern. Die Interaktion der Untereinheiten mit anderen zellulären Proteinen mag als funktioneller regulatorischer Mechanismus dienen, ebenso wie ihre Translokation in der Zelle als Antwort auf diverse Stimuli. Die einzelnen Untereinheiten der CK2 kommen außer im Holoenzym auch noch in anderer Form, sei es frei oder an andere Proteine gebunden, vor. Es gibt zahlreiche Befunde, die zeigen, dass die Proteinkinase CK2 in verschiedenen subzellulären Kompartimenten und auf der Zelloberfläche gefunden werden kann und dass die subzelluläre Lokalisation ein dynamischer Prozess ist. Es gibt einige Hinweise, dass es möglicherweise CK2 bindende Proteine gibt, die für dieses subzelluläre Targetting verantwortlich sind.
In vielen Tumoren liegt CK2 dysreguliert vor, wobei sowohl die Expression als auch die Aktivität erhöht ist. Transgene Modelle zeigen, dass schon eine geringe Dysregulation der CK2-Aktivität ein oncogenes Potential bergen kann. In transgenen Mäusen hat man nach geringer Überexpression der CK2alpha- Untereinheit eine verstärkte Bildung von Lymphomen beobachten können. Dabei arbeitet die CK2 wohl in Kooperation mit anderen Faktoren wie dem c-myc oder auch Tal-1 oder p53 zusammen. Das oncogene Potential der CK2 beruht darauf, dass sie entweder die Proliferation stimulieren oder den Prozess der Apoptose verhindern kann. Studien zur androgenen Regulation der Prostata der Ratte geben Hinweise auf beides. CK2 spielt als Apoptoseschutz, im Falle der Krebszellen auch unerwünscht, eine nicht zu unterschätzende Rolle.




