Therapie der Gliome
Den Gliomen werden Astrozytome, Oligodendrogliome und Ependymome zugerechnet. Mischtumoren mit unterschiedlich großen Anteilen der beiden Komponenten kommen als Astrooligodendrogliome oder Oligoastrozytome in ca. 10-15 % aller Gliome vor. Das Glioblastom (GBM) stellt die bösartigste Variante (immer Grad IV) dar (siehe Tabelle 1).
Tabelle 1: Zusammenstellung der Gliome:
| Tumorfamilie | Tumorentität | Grad I | Grad II | Grad III | Grad IV | ||||||||||||||||||||
| Astrozytäre Tumore |
| ||||||||||||||||||||||||
| Oligodendrogliome |
| ||||||||||||||||||||||||
| Mischgliome |
| ||||||||||||||||||||||||
| Ependymale Tumore |
|
Über die Altersverteilung der Glioblastome und die resultierende Prognose informiert Tabelle 2.
Tabelle 2: Altersverteilung und Prognose der Glioblastome.
Altersgruppe | Zahl der Patienten | 1-Jahres- Überleben [%] | 2-Jahres- Überleben [%] | 5-Jahres- Überleben [%] | 10-Jahres- Überleben [%] |
0 ? 19 | 244 | 51 | 28,8 | 19,3 | 16,4 |
20 ? 44 | 1643 | 58,9 | 29,8 | 13,4 | 8,4 |
45 ? 64 | 5872 | 34,8 | 7,8 | 2,1 | 1,0 |
> 65 | 5974 | 13,3 | 2,1 | 0,3 | 0,2 |
Operation:
Neuere Untersuchungen haben gezeigt, dass die z.B. nach MRT-Kriterien vollständige operative Entfernung die Prognose des Patienten verbessert (siehe Tabelle 3 und Abbildung 1).
Tabelle 3: Radikale Operation verbessert die Überlebenszeit
Simpson JR et al. | Int J Radiat Oncol Biol Phys 1993 |
Albert FK et al. | Neurosurg1994 |
Barker FG et al. | J Neurosurg 1996 |
Keles GE et al. | Surg Neurol 1999 |
Scott JN et al. | Ann Neurol 1999 |
Becker G et al. | Neurosurg 1999 |
Wirtz CR et al. | Neurosurg 2000 |
Lacroix M et al. | J Neurosurg 2001 |
Stummer W et al. | Lancet Oncol 2006 |
Ziel der operativen Behandlung sollte also die möglichst vollständige Tumorentfernung sein, wenn diese aufgrund der Lokalisation und der Wachstumsform möglich erscheint, ohne unvertretbare Risiken hinsichtlich einer dauerhaften Morbidität einzugehen.
Primäre Ziele der Operation:
Histologische Diagnose
Symptomreduktion
Drainage von Liquor
Ermöglichen einer adjuvanten Therapie
Zytoreduktion
Sekundäre Ziele der Operation:
Chemosensitivitätstestung
Tumorbasierte Vakzination
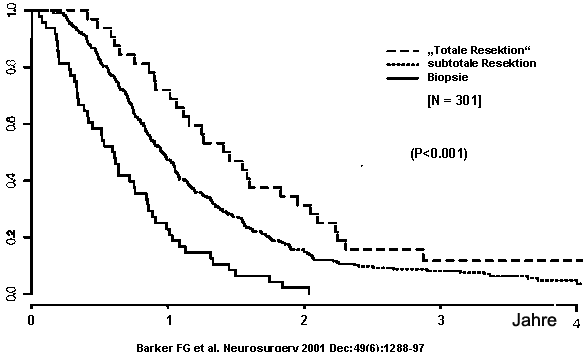
Abbildung 1: Überlebenszeit der Patienten in Abhängigkeit von der Radikalität der Operation.
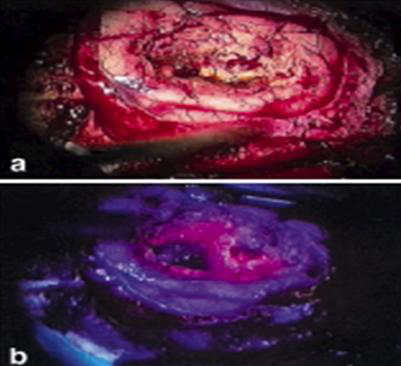
Fluoreszenzgestützte Operation
Wünschenswert ist daher die intraoperative Kontrolle der Radikalität der Tumorentfernung. In diesem Bereich hat sich in der Tumorchirurgie die fluoreszenzgestützte Tumorresektion mit 5-ALA als nützlich erwiesen. 5-ALA ist eine körpereigene Substanz, die bevorzugt im Gewebe maligner Gliome zu einem stark fluoreszierenden Farbstoff umgewandelt wird, dem Protoporphyrin IX. Dieser unter blauviolettem Licht stark leuchtende Farbstoff erlaubt nun die bessere Abgrenzung von Tumorgewebe, wodurch die Operation sicherer und vollständiger wird (siehe Abb 2). Hiermit wird zum einen das Ausmaß der Radikalität noch intraoperativ beurteilbar und die Patientensicherheit und Operationsqualität wesentlich verbessert.
|
|
Abbildung 2.: 2a: Intraoperatives Bild eines Glioblastomes | Film 1:Fluoreszenzgestützte Entfernung eines Glioblastoms startet nach dem klicken auf das Bild |
Neuronavigation
Eine weitere intraoperative Möglichkeit Patientensicherheit und Operationsqualität zu verbessern ist die Neuronavigation. Durch die Neuronavigation ist es dem Operateur während der laufenden Operation möglich sich anhand praeoperativ generierter NMR-Bilder, welche dreidimensional dem OP-Rechner zur Verfügung gestellt werden, zu orientieren (siehe Abbildung 3). Dies ermöglicht:
einen kleinen und schonenden operativen Zugang
On-line Orientierung in den bildgebenden Untersuchungsverfahren
Einbeziehung fast aller OP-Instrumente inkl. Mikroskop
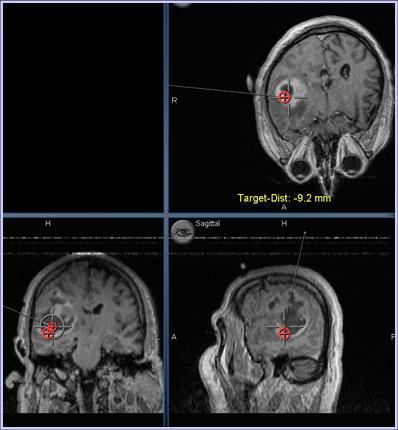
Abbildung 3.: Intraoperatives dreidimensionales Bild im Rahmen der mikrochirurgischen Operation eines Glioblastomes.
Trotz aller neuesten wissenschaftlichen Fortschritte ist die kurative Resektion eines malignen Glioms (WHO Grad III und IV) theoretisch ausgeschlossen, auch wenn zunächst häufig bildgebend keine Hinweise auf einen Resttumor bestehen. Die Ursache liegt im biologischen Verhalten dieser Tumore, insbesondere in ihrem invasiven Wachstum entlang präformierter, neuroanatomischer Strukturen. Durch alleinige Operation maligner Gliome ohne adjuvante Radio- und Chemotherapie werden daher mediane Überlebenszeiten von ca. 3-4 Monaten nach Diagnosestellung erreicht. Nach heutiger Auffassung wird auch beim Rezidiv eines malignen Glioms und insbesondere bei jüngeren Patienten in gutem klinischen Zustand und nach gutem Ansprechen auf die initiale Therapie zu einer erneuten Operation geraten.
Radiotherapie
Eine postoperative Strahlenbehandlung oder die primäre Bestrahlung im Falle der Inoperabilität sind elementare Bestandteile der Therapie maligner Gliome. Die mittlere Überlebenszeit wurde durch eine Ganzhirnbestrahlung mit 50-60 Gy bei malignen Gliomen insgesamt von 17,5 Wochen nach Operation alleine, auf 37,5 Wochen nach Operation und Bestrahlung in der Gesamtgruppe der malignen Gliome erhöht. Es konnte in anderen Arbeiten gezeigt werden, dass die mittlere Überlebenszeit bei einer Gesamtdosis von 55-60 Gy signifikant länger ist als mit einer Dosierung unter 55 Gy. Aus diesem Grunde ist eine Gesamtstrahlendosis bei externer konventioneller Strahlentherapie der Glioblastome von 55-60 Gy etabliert. Die externe konventionelle Strahlentherapie entspricht der bei anaplastischen Astrozytomen.
Modifizierte Strahlentherapieverfahren wie der Hochlinearenergie-Bestrahlung mit schnellen Neutronen oder schweren Eisenatomen befinden sich in verschiedenen Zentren derzeit in der Erprobung. Die Anwendung einer lokalen Strahlentherapie, d.h. die interstitielle Brachy-Therapie oder die stereotaktische Zielbestrahlung mit einem Linearbeschleuniger (Gamma-Knife) ist bei Glioblastomen limitiert durch die Größe und das infiltrative Wachstum, so dass diese Therapieformen nur bei selektionierten Fällen und in hoch spezialisierten Zentren zur Anwendung gebracht werden.
Chemotherapie
Gegenüber Operation und Strahlentherapie war bisher der Stellenwert der adjuvanten Chemotherapie gemessen an der medianen Überlebenszeit deutlich geringer. Besonders Patienten mit guten prognostischen Faktoren können jedoch von einer Chemotherapie profitieren. Dazu zählen:
jüngeres Alter (< 45 Jahre)
hoher Karnofsky-Index (> 70%)
längeres symptomatisches Intervall vor Diagnosestellung
Zu den wirksamsten zytostatischen Substanzen in der Therapie maligner Gliome gehören Nitrosoharnstoffe, wie ACNU, BCNU und CCNU, die aufgrund ihres ähnlichen Wirkungsmechanismen zu vergleichbaren Studienergebnissen geführt haben (Tabelle 4). Nitrosoharnstoffe erbrachten bei Patienten mit malignen Gliomen eine Verlängerung der medianen Überlebenszeit um 1-3 Monate auf etwa 12 Monate nach vorausgegangener Operation und Bestrahlung. Es gelang, den Teil der Patienten, die länger als 18 Monate überleben, von ca. 5% auf 15% zu steigern.
Standard der Primärtherapie des Glioblastoms war bis zum Jahr 2004 die Operation gefolgt von der Strahlentherapie der erweiterten Tumorregion.
Die parallele Radio-Chemotherapie
Temozolomid ist wie die Nitrosoharnstoffe eine alkylierende Substanz, die die Blut-Hirn-Schranke gut penetriert und bei oraler Applikation einem Liquorspiegel von 30% des Serumspiegels erreicht. Seit 1999 ist das Medikament zur Primärtherapie des Glioblastoms zugelassen. Auf Grund der guten Ergebnisse in der EORTC Studie 26981 in der simultanen Anwendung, zusätzlich zur Strahlentherapie, hat sich heute die simultane Radio-Chemotherapie des Glioblastoms als Standardtherapie etablieren können (Abb. 4).
Tabelle 4: Ergebnisse ausgewählter klinischer Studien mit verschiedenen Chemotherapie-Protokollen bei malignen Gliomen
Protokoll | Mediane ÜLZ (Wo.) | Referenzen |
| BCNU | 50 | Green et al. 1983 |
| BCNU | 50 | Krauseneck 1989 |
| CCNU | 52 | Trojanowski 1989 |
| Procarbacin | 47 | Green 1983 |
| ACNU | 61 | Shibata 1987 |
| BCNU + Procarbazin | 50 | Shapiro 1976 |
| BCNU + VM26 | 53 | Krauseneck 1989 |
| CCNU + VM26 | 58 | EORTC BTG 1981 |
| CCNU + Vinc. +MTX +Procarbacin | 64 | Jellinger 1979 |
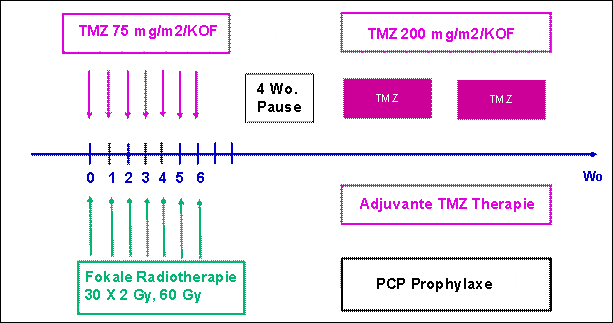
Abb. 4: Studiendesign der EORTC 26981 Studie
| Die Behandlung mit Temozolomid (TMZ) zusätzlich zur Strahlentherapie in der Primärtherapie des Glioblastoms verlängert die mediane Überlebenszeit von 12,1 Monaten auf 14,6 Monate und erhöht die Rate des 2-Jahresüberlebens von 10% auf 26%. |
Die lokale (intraoperative) Chemotherapie
Die lokale Applikation einer Wirksubstanz in die Tumor- oder Resektionshöhle selbst kann intraoperativ als Einmalgabe durchgeführt werden. Hierbei werden Cytostatika, welche an bioabbaubare Polymere gekoppelt wurden, lokal in die Resektionshöhle eingebracht (siehe Abbildung 5 + 6).
Abbildung 5: BCNU-Polymer vor der intraoperativen Implantation.
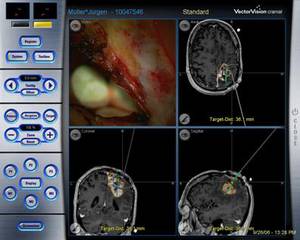
Abbildung 6: Intraoperative Applikation der Chemotherapie (BCNU-Polymer) unter Neuronavigationskontrolle
Die lokale Chemotherapie ist gegenüber Operation und Strahlentherapie von untergeordneter Bedeutung, jedoch stellen künftige Entwicklungen der Chemotherapie eine Hoffnung auf Verbesserung der Therapieoptionen dar, da die operativen, sowie die Bestrahlungstechniken so ausgereift sind, dass von ihnen keine wesentlichen Verbesserungen in den kommenden Jahren zu erwarten sind.