Ethik-Kommission: Ein lästiges Übel? Eine zwingende Notwendigkeit?
Ein Beitrag von Prof. Dr. Hermann Schieffer, Vorsitzender der Ethik-Kommission der Ärztekammer des Saarlandes
Allgemeines über Ethik-Kommissionen
Seit den 70er Jahren wurden Ethik-Kommissionen ein wichtiges Instrument bei der Beurteilung des ethischen Verhaltens in konkreten medizinischen Sachfragen, insbesondere der wissenschaftlichen Forschung.
Ethik-Kommissionen sind multidisziplinär zusammengesetzte Beratungsgremien. Sie sollen ärztliche Arbeit transparent machen, die Handelnden über die rechtlichen und sittlichen Aspekte ihrer beabsichtigten Handlungsweise beraten und damit Verstöße gegen ethische Normen und Grundanschauungen verhindern.
Sie sollen insbesondere Patienten und Probanden davor schützen, dass Forschung und Ärzte in ihrem Drang nach Wahrheit und neuer Erkenntnis die Grenzen des Zulässigen und ethisch Vertretbaren überschreiten. Es soll aber auch der Arzt selbst durch die Beratung geschützt werden, z. B. vor Haftpflichtansprüchen. Ethik-Kommissionen können aufgrund ihrer Erfahrungen politische Entscheidungsträger bei Gesetzgebung, Gesundheitsplanung und Forschungsförderung fachlich beraten. Als Beispiel sei genannt:
- Enquete-Kommission des Bundestages
- Der Nationale Ethikrat
- Die Ethik-Kommission beim Bundeskanzleramt.
Die Ethik-Kommissionen der Ärzteschaft sind Bestandteil der öffentlich-rechtlichen Organisation ihrer Träger, der Ärztekammern, der Medizinischen Fakultäten aber auch in so genannter Freier Trägerschaft (durch die Pharmaindustrie getragen). Sie beraten und geben zustimmende oder ablehnende Voten ab, diese können mit Hinweisen, Ratschlägen oder Empfehlungen versehen werden.
Historische Entwicklung
Den Anstoß zur Errichtung von Ethik-Kommissionen gab 1975 der Weltärztebund in Tokio mit seiner mehrfach revidierten Deklaration von Helsinki (1964).
Im Saarland entstand bereits 1978 ein Seminar für ?Fragen ärztlicher Ethik? durch Professor Fritsche, ein ?Medizinisch-juristischer Arbeitskreis?, der sich mit berufsethischen und rechtlichen Fragen in der klinischen Medizin befasste.
1983 wurde eine Ethik-Kommission nach einer Vereinbarung zwischen Medizinischer Fakultät und Landesärztekammer gebildet, wobei letztere die Federführung übernahm.
1998 wurde dann im Saarländischen Heilberufekammergesetz die Ethik-Kommission verankert (§ 5), die für alle saarländischen Ärzte, auch für die der Medizinischen Fakultät zuständig ist.
In dieser Kommission sind neben Ärzten und Juristen, die mit klinischen Studien vertraut sind, auch medizinische Laien vertreten. Sie überprüfen anhand folgender Fragen sehr genau, ob alle Schutzbestimmungen eingehalten werden:
- Werden die Patienten evtl. unnötigen Gefahren ausgesetzt?
- Sind die Information und die Einverständniserklärung für medizinische Laien verständlich?
- Werden die gesetzlichen Bestimmungen beachtet?
- Ist eine besondere Probandenversicherung notwendig?
Werden von der Ethik-Kommission Mängel entdeckt, dann müssen diese zunächst beseitigt werden, bevor mit der Studie begonnen werden darf. Auch während die Studie läuft, muss die Ethik-Kommission über alle Ereignisse oder Erkenntnisse informiert werden, welche die Sicherheit der Patienten gefährden könnten. Unter Umständen muss eine Studie dann abgebrochen werden.
Leistungszahlen
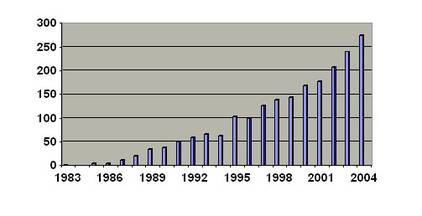
Anzahl aller, bei der Ethik-Kommission seit Gründung eingegangenen AnträgeDie Zahl der zu bearbeitenden Anträge: 1983 ein Antrag, 2003 waren es bereits 240 Anträge, in 2004 insgesamt 286 Anträge. Davon waren 175 multizentrische/ multinationale Studien (das sind Studien, die an verschiedenen Prüfstellen international durchgeführt werden), 54 Studien waren monozentrischer Natur, d.h. das Forschungsvorhaben wird nur an einem Zentrum im Saarland durchgeführt. Im Jahr 2003 waren 11 multizentrische Studien, deren Leiter der klinischen Prüfung im Saarland beheimatet war, sodass unsere Ethik-Kommission für diese Studienvorhaben bundesweit federführend verantwortlich zeichnete.Nicht mit aufgeführt in dieser Grafik sind die vielen Prüfplanänderungen, die sich aufgrund des klinischen Verlaufs ergeben, die Amendments (Ergänzungen) und die unvorhergesehenen und unerwarteten Ereignisse bei Forschungsvorhaben, die von der hiesigen Kommission votiert wurden und die Gegenstand einer Sitzung waren oder werden müssen.Wichtig vor allem ist die laienverständliche Patienteninformation und Einwilligungserklärung sowie ein Extrapassus zum Datenschutz.
Behörden
Jede laufende Studie muss bei den Aufsichtsbehörden der Bundesländer angemeldet werden. Die Behörden haben das Recht, je nach Bedarf weitere Informationen über die Studie einzuholen oder die beteiligten Kliniken und Arztpraxen (also die Prüfzentren) zu besuchen und zu überprüfen.
Bei klinischen Prüfungen mit noch nicht zugelassenen Arzneimitteln ist das Bundesinstitut für Arzneimittel und Medizinprodukte in Bonn (BfArM) für die Zulassung zuständig, bei Blutprodukten und Impfstoffen das Paul-Ehrlich-Institut ? Bundesamt für Sera und Impfstoffe in Langen.
Treten schwerwiegende Nebenwirkungen (SAE?s) auf, so müssen diese zunächst der zuständigen Ethik-Kommission gemeldet werden, gleichzeitig aber auch den Zulassungsbehörden, die alleine einen Überblick haben über alle Arzneimittel, die gerade geprüft werden. Falls Sicherheitsbedenken auftreten, greifen beide Institutionen ein.
Qualifikation einer Ethik-Kommission
Jede Ethik-Kommission (gleich ob rein universitär oder nach Landesrecht gebildet) muss eine Reihe von Qualifikationen absolvieren und von Seiten der Regierung zugelassen werden. Sie muss unter Beachtung der internationalen Richtlinien der GCP (Good Clinical Practice) arbeiten. Die ?Gute Klinische Praxis? ist ein internationaler ethischer und wissenschaftlicher Standard für Planung, Durchführung, Dokumentation und Berichterstattung von klinischen Prüfungen am Menschen. Die Einhaltung dieses Standards schafft öffentliches Vertrauen und sorgt dafür, dass die Rechte, die Sicherheit und das Wohl der Prüfungsteilnehmer (Probanden/Patienten) gemäß der Deklaration von Helsinki geschützt werden und die bei der klinischen Prüfung erhobenen Daten glaubwürdig sind.
Zielsetzung dieser GCP (Gute Klinische Praxis) Leitlinie und einer International Conference on Harmonisation (ICH) ist es, für die Europäische Union (EU), Japan und die Vereinigten Staaten (USA) einen einheitlichen Standard zu schaffen, der die gegenseitige Anerkennung klinischer Daten durch Zulassungsbehörden in den jeweiligen Zuständigkeitsbereichen fördert.
Diese harmonisierte Leitlinie ist am 17. Januar 1997 in Kraft getreten und hatte bisher nur ?empfehlenden Charakter?, wobei nationales Recht noch vorrangig war.
Diese Empfehlungen sind 2001 vom Europäischen Parlament und dem Europäischen Rat durch Ratifizierung EU-weit verbindlich geworden und mussten nun in nationales Recht umgesetzt werden. Seit Mitte August sind die 12. Novelle zum Arzneimittelgesetz (AMG) und die Verordnung über die Anwendung der ?Guten Klinischen Praxis? (GCP) bei der Durchführung von klinischen Prüfungen mit Arzneimittel zur Anwendung am Menschen in Deutschland rechtswirksam und müssen angewandt werden.
Dadurch haben sich die Rahmenbedingungen für die Durchführung von klinischen Arznei-mittelstudien wesentlich geändert und stellen alle Beteiligten (Sponsoren, Prüfärzte, Behörden und Ethik-Kommissionen) vor nicht unerhebliche neue Aufgaben und vor allem Haftungsprobleme.
Politische Zielsetzung
Die politische Zielsetzung erläutert die Bundesgesundheitsministerin Ulla Schmidt. Sie führte dazu aus, dass (Zitat) ?damit im Interesse des Patientenschutzes klare Regeln für die klinische Forschung mit Arzneimitteln geschaffen werden und die Sicherheit von Medikamenten gerade für Kinder deutlich gesteigert wird; zugleich wird die klinische Forschung und damit die Entwicklung neuer und besserer Arzneimittel in Europa vereinheitlicht und optimiert? (Zitatende).
Der dafür notwendige zeitliche, personelle und finanzielle Aufwand ist enorm und führt zu einer weiteren ?Verbürokratisierung?. Die Ethik-Kommissionen werden aus ihrer reinen Beratungsfunktion in einen ?Behördenstatus? gedrängt, ohne deren Zustimmung eine klinische Studie nicht begonnen werden darf, außerdem entscheiden sie nicht nur über den inhaltlichen Wert einer Studie sondern auch über die Qualifikation des Prüfarztes und des Prüfzentrums.
Besonders betroffen durch das Arzneimittelgesetz und die Verordnung für ?Good Clinical Practice? (GCP) sind die klinischen Studien, die an so genannten einwilligungsunfähigen Menschen durchgeführt werden sollen. Das sind Menschen, die Wesen, Bedeutung und Tragweite des Eingriffs, sowie Risiken und Belastungen der Teilnahme an einem Forschungsprojekt nicht oder nur begrenzt erfassen, abwägen und beurteilen können (so genannte Einsichtsunfähigkeit) und die nicht in der Lage sind, einen eigenen Willen dazu zu bilden und zu äußern ? wie z. B. Menschen mit schwerer geistiger Behinderung, mit Demenzerkrankung und vor allem Kinder. Insbesondere in der Kinderheilkunde erschweren die oben genannten Auflagen die klinischen Studien, zumal solchen eine zunehmend kritische ?Öffentlichkeit? sowie auch Sozialgerichtsurteile entgegenstehen. Kontrovers ist die Diskussion insbesondere dann, wenn keine Aussicht besteht, dass die Forschung diesen Probanden selbst zugute kommen wird. In diesem Rahmen besteht noch erheblicher Diskussionsbedarf.
Aber es gilt nicht nur Arzneimittel zu bewerten, sondern auch klinische Studien, die sich mit Medizinprodukten befassen und die nach dem Medizinproduktegesetz (MPG) zu überprüfen sind, dabei handelt es sich um am Menschen einsetzbare Produkte wie z. B. Schrittmacher, Sonden, Insulinpumpen sowie alles endoskopische Instrumentarium.
Finanzierung
Bei den fakultätseigenen Ethik-Kommissionen wird Haftung und Finanzierung des gesamten Apparates einer Ethik-Kommission von der Universität und damit indirekt vom jeweiligen Bundesland getragen. Anders bei den Ethik-Kommissionen, deren Träger eine Landesärztekammer ist, die dementsprechend auch haftet und die die nicht unerheblichen Kosten einer solchen, quasi Behördenstatus erlangten Einrichtung, tragen muss. Das heißt, alle saarländischen Ärzte finanzieren mit ihren Kammerbeiträgen die Unterhaltung einer Ethik-Kommission. Deren Mitglieder arbeiten ehrenamtlich.
Fazit
Die Beantwortung der Frage nach Sinn und Zweck von Ethik-Kommissionen, wie sie einleitend gestellt wurde, kann wie folgt beantwortet werden. Sie bedingen:
- Sicherstellung der Qualität der klinischen Studien,
- Sicherstellung, dass erhobene Daten glaubwürdig und nachvollziehbar sind,
- Rechtsschutz für Patienten/Probanden,
- Datenschutz.
Kontrovers wird die medizinische Forschung an so genannten einwilligungsunfähigen Menschen diskutiert und augenscheinlich erheblich erschwert. Dies betrifft vor allem die klinischen Studien in der Kinderheilkunde die von der Sache her dringend notwendig wären, deren Möglichkeiten und Grenzen es jedoch erst auszuloten gilt.
Prof. Dr. Hermann Schieffer,
Vorsitzender der Ethik-Kommission
der Ärztekammer des Saarlandes
Saarbrücken, im Januar 2005




