Nachweis von pathologischem Prionprotein
Prionerkrankungen sind zwar selten, aber deshalb von großer Bedeutung, weil sie nach derzeitigem Wissen als einzige Proteinaggregationserkrankung in vergleichbarer Form bei Menschen wie Tieren vorkommt und nicht nur innerhalb einer Art, sondern auch über die Artenbarriere hinweg übertragbar sind. Der Umstand der Übertragbarkeit stellt an die Diagnostik besondere Anforderungen.
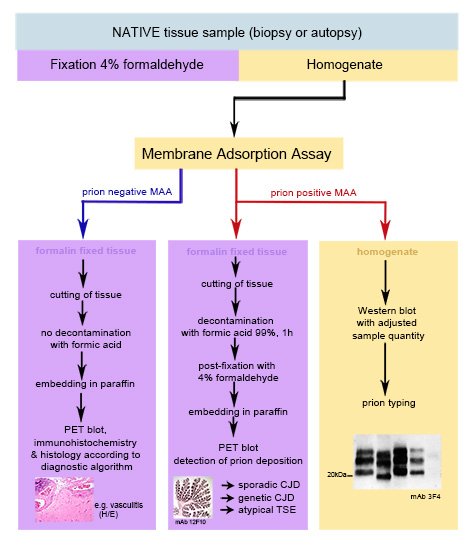
Klinisch sind Prionkrankheiten durch einen meist sehr raschen Verlauf und eine neurologische Multisystemerkrankung charakterisiert Der Nachweis von pathologischem Prionprotein zur Bestätigung einer Prionkrankheit kann im Hirngewebe post mortem oder anhand einer Biopsie durchgführt werden.
Wir verwenden einen sehr sensitiven Membranadsorptions Assay (MAA) [1] als schnelle Methode am nativen Material, um das Vorhandensein pathologischer Prionaggregate festzustellen. Mittels Western blot wird dann das pathologischen Prionprotein anhand von Größe und Intensität der Proteinfragmente, die nach einem sehr kräftigen Enzymverdau zurückbleiben, weiter charakterisiert. Aggregate vom Priontyp 1 oder 2 geben Auskunft darüber, ob ein klinisch primär dementielles oder primär ataktisches Krankheitsbild ausgelöst worden ist [2].
Das in der Zwischenzeit in Formalin fixierte Gewebe wird im Fall einer Prionkrankheit zum Schutz der Mitarbeiter mit Ameisensäure dekontaminiert und in der Folge in Paraffin eingebettet. Am Paraffinschnitt werden die relevanten immunhistochemischen Untersuchungen durchgeführt. Für den Nachweis des Verteilungungsmusters und die Charakterisierung der Prionaggregate wird der Paraffinschnitt auf eine Nitrocellulose Membran aufgezogen und das sehr sensitive Paraffin-embedded-tissue blot (PET-blot) Verfahren [3] angewandt, mit dem auch besonders feine Ablagerungen von Prionaggregaten nachgewiesen werden können.
Wenn Sie eine Biopsie oder Autopsie zur Abklärung auf Prionaggregate planen, nehmen Sie bitte vor der Entnahme Kontakt zu uns auf (06841-1623848 oder 06841-1623865)!
[1] Wemheuer et al. 2009 AmJPathol “Filtration of Protein Aggregates Increases the Accuracy
for Diagnosing Prion Diseases in Brain Biopsies”
[2] Parchi et al., 1997 Nature “Typing prion isoforms“
[3] Schulz-Schaeffer et al., 2000 AmJPathol “The Paraffin-Embedded Tissue Blot Detects PrPSc
Early in the Incubation Time in Prion Diseases”