Tumorzytogenetik
Die Tumorzytogenetik befasst sich mit der Analyse erworbener Chromosomenveränderungen hämatologischer Erkrankungen und soliden Tumoren, die häufig für den jeweiligen Tumor spezifisch sind und für die Therapie und Prognose von Bedeutung sind.
Die Anfänge der Tumorzytogenetik reichen weit zurück: der deutsche Pathologe David von Hansemann berichtete schon 1890 von auffälligen Kernveränderungen und gestörten Teilungsfiguren in Schnittpräparaten von Karzinomen. Er vermutete, dass zwischen diesen Veränderungen und der Entstehung von malignen Tumoren ein Zusammenhang bestehen könnte. 24 Jahre später griff der deutsche Zoologe Theodor Boveri diese Vorstellung auf und formulierte unter Hinzunahme eigener Beobachtungen die sogenannte "Chromosomenhypothese" der Tumorentstehung. Danach werden Veränderungen im Chromosomensatz einer Zelle als Vorraussetzung für den Übergang von normalem Wachstum zu maligner Proliferation angesehen.
Die erste in neoplastischem Gewebe gefundene Chromosomenanomalie war eine Deletion von Chromosom 22, später identifiziert als eine Translokation der Chromosomen 9 und 22- das "Philadelphiachromosom". Dadurch kommt es bei der chronischen myeloischen Leukämie zur Bildung eines proliferationsaktivierenden Fusionsgens. Die zweite Beobachtung war an soliden Tumoren: der Verlust eines G-Gruppen-Chromosoms in Meningeomen, einem gutartigen Hirntumor, welches später als Chromosom 22 identifiziert werden konnte.
Diese Beobachtung von Prof. Zang bildete vor fast 40 Jahren den Grundstein der Tumorzytogenetik der soliden Tumoren. Heute ist der genetische Status von Hirntumoren von großer Bedeutung. So können bei verschiedenen Tumor-Untergruppen, die im Tumor gefundenen genetischen Veränderungen als Hinweis auf die bestmögliche individuelle Therapie des jeweiligen Patienten genutzt werden. So lässt sich heute zum Beispiel bei den Oligodendrogliomen der Verlust des kurzen Arms von Chromosom 1 in Kombination mit einem Verlust des langen Arms von Chromosom 19 als Marker für ein sehr gutes Ansprechverhalten der Patienten auf PCV-Chemotherapie verwenden. Somit geben diese genetischen Marker einen Hinweis auf eine verlängerte progressionsfreie Zeit bzw. Gesamtüberlebenszeit der betroffenen Patienten.
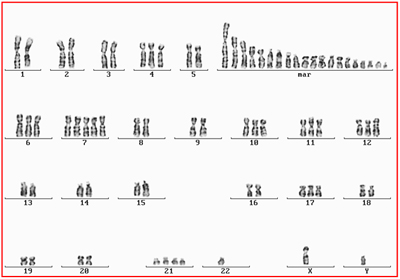
Abbildung 1. KonventionelleChromosomenanalyse: G-Bänderung des Glioblastoms T 5135.
GTG- Karyotyp: 70-86,[4n],cx,XXYY,dup(1)(q25-44)x2,-3,-4 ,-5,+7,+7, +der(7),-8,-8,-10,-10,
-11,-12,-13,-13,-14,-14,der(14),-16,-17,-18,-19, -19, -20,-20,+10-15 mar, [cp15]

Abbildung 2. SKY-Klassifikation eines Glioblastoms
Als weiteres Beispiel sind die Glioblastome zu nennen, der häufigste und maligneste Tumor des ZNS des Menschen. Jährlich wird er in Deutschland bei etwa 4000 Menschen diagnostiziert. Gekennzeichnet sind diese durch ein diffus infiltrierendes Wachstum, wodurch eine komplette operative Entfernung dieser Tumoren nahezu unmöglich ist und bis heute die Behandlung rein palliativ bleibt. Die Prognose der Patienten ist sehr ungünstig und der klinische Verlauf ist abhängig vom Ansprechverhalten auf Strahlen- und/oder Chemotherapie, so dass die Überlebenszeit meist nur ca. 14 Monate beträgt.
Auch bei Glioblastomen sind mittlerweile viele genetische Veränderungen bekannt (Abb1., Abb2.), die zum Teil mit einer schlechten Prognose korreliert sind, wie der Verlust des kurzen Arms von Chromosom 9 und der Verlust des langen Arms von Chromosom 10. In einer kürzlich durchgeführten Studie konnten wir zeigen, dass interessanterweise aber gerade diese Patientengruppen erheblich von einer Temozolomid-Chemotherapie profitieren (Abb. 3). Weiterhin zeigte sich, dass die ungünstige Prognose älterer Glioblastom-Patienten durch die TMZ-Therapie kompensiert werden konnte. Dieser Effekt trat in Abhängigkeit der chromosomalen Veränderungen auf 7p, 10q und 13q auf, die zudem mit einem späteren Erkrankungsalter assoziiert sind (Wemmert et al. 2005). Dies ist insofern von großer klinischer Bedeutung, da gerade den älteren Patienten aufgrund eines oft schlechteren Allgemeinzustandes eine doch belastende Chemotherapie nicht zugemutet werden kann.
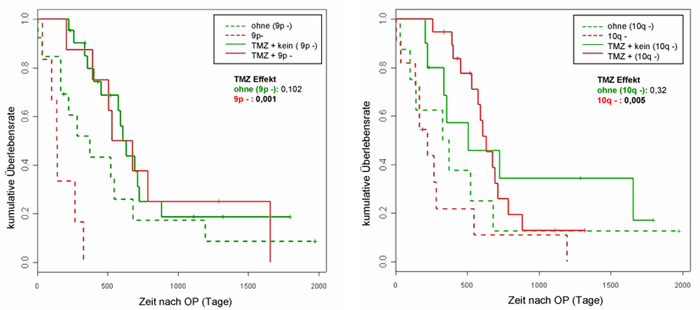
Abbildung 3. Kaplan-Meier Analyse: A) Überlebenszeit der Patienten mit 9p-Verlust (9p-) in der TMZ-Gruppe vs. Gruppe mit ausschließlicher Bestrahlung. B) Überlebenszeit der Patienten mit 10q-Verlust (10q-) in der TMZ-Gruppe vs. Gruppe mit ausschließlicher Bestrahlung.
Somit waren wir in der Lage, Subgruppen zu definieren, die ein unterschiedliches Ansprechverhalten zeigten - ein wertvoller Beitrag zur Therapieempfehlung, der nun in unseren weiteren experimentellen Untersuchungen verfolgt und verifiziert wird.




