Warum funktioniert's?
Für den Transfer der Moleküle auf die Membran sind heute verschiedene Verfahren geläufig: Diffusions- oder Kapillarblotting, Vakuum-Blotting und Elektroblotting. Während sich beim “Southern-“ und “western-Blot” das Kapillarblotting etabliert hat, wird bei Proteinen das Elektroblotting bevorzugt.
Generell unterscheiden sich die Verfahren an Hand der Kraft, die die aufgeteilten Fragmente transferiert.
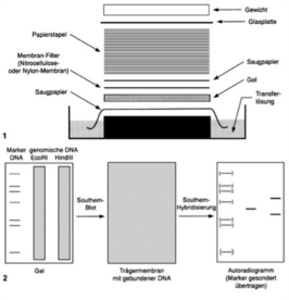
Bei der ursprünglichen Methode, dem “Southern Blotting”, wird der Transfer der Moleküle durch einen kapillaren Flüssigkeitsstrom erreicht, der durch die Verwendung eines Stapels saugfähigem Filterpapier erzeugt wird.
Diese Technik kann in drei wesentliche Teilschritte untergliedert werden:
1) Die Spaltung und gelelektrophoretische Auftrennung des zu untersuchenden Materials,
2) der Transfer der Fragmente auf eine geeignete Trägermembran,
3) die Immobilisierung der transferierten Moleküle und zuletzt der Nachweis spezifischer Fragmente durch Hybridisierung mit markierten Sonden.
Mit demselben Prinzip funktioniert auch das Verfahren des Vakuum-Blots, allerdings wirkt hier, wie der Name schon vermuten lässt, ein angelegtes Vakuum als transferierende Kraft, die die Flüssigkeit durch Gel und Membran zieht.
Beim Elektro-Blotting von mittels SDS-PAGE aufgetrennten Proteingemischen wird eine elektrophoretische Transfermethode verwendet.
Für diesen in der Regel beim “westernBlot” verwendeten Transfer werden Proteine über ein senkrecht zum Gel angelegtes elektrisches Feld eluiert und so auf die Membran transferiert, während die elektrophoretische Auftrennung erhalten bleibt. Die Proteine wandern aus dem Gel und bleiben aufgrund hydrophober Wechselwirkung an der Membran haften. Je nach Struktur der Proteine werden verschiedene Pufferlösungen verwendet. So gewährleistet der Zusatz von SDS beispielsweise einen besseren Transfer von hydrophoben Proteinen, während ein Zusatz von Methanol das Quellen des Gels verhindert. Ist aber beispielsweise eine Beibehaltung der Aktivität der Enzyme gewünscht, darf der Transferpuffer kein Methanol enthalten. Außerdem kann zwischen verschiedenen Blot-Membranen gewählt werden. Diese unterscheiden sich im Material und damit in der Hydrophobizität der Oberfläche, aber auch in ihrer Morphologie und damit in ihren unterschiedlichen Verhältnissen von spezifischer und geometrischer Oberfläche. Je nach Struktur des verwendeten Proteins ist dann die Auswahl von fein- bzw. grobporigen Membranen günstiger.
Für den Elektroblot sind zwei verschiedene Verfahren gebräuchlich, das Tankblotting und das semidry-Blotting.
Tankblotting
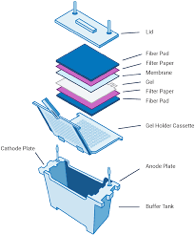
Bei den erstmals nach einer von Bittner et al. im Jahre 1980 vorgestellten Blotting-Tanks handelt es sich um vertikale Puffertanks. Senkrecht im Tank liegt eine Gitterkasse, in die das die Moleküle enthaltene Gel, die Membran, Filterpapiere und Schwämme geschichtet wurden. Für den Transfer wird meist ein niedermolarer Tris-Glycin-Puffer, dem, wie bereits oben erwähnt, zur erhöhten Bindungseffizienz der Proteine 10-20% Methanol zugesetzt worden ist, verwendet. Durch seitlich angebrachte Platindrähte wird eine konstante Spannung von in der Regel 50mV am Tank generiert, um durch ein konstantes elektrisches Feld eine gleichmäßige Kraft auf die Ladungsträger auszuüben. Je nach Größe des Tanks und Molarität des Blotpuffers variiert die angelegte Stromstärke zwischen 100 und 500 mA, wobei diese durch Zunahme des Ohmschen Widerstands während des Transfers sinken kann. Je nach Spannung und Stromstärke ist eine Kühlung des Systems notwendig, die durch vertikal in den Tank eingesetzte Kühlvorrichtungen erreicht wird.
Semidry Blotting
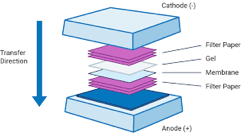
Im Jahr 1984 wurde von Kyse-Andersen erstmals eine alternative Apparatur, das semidry-Blotting, beschrieben. Für dieses Verfahren wird ein so genanntes “Blotsandwich” aus Filterpapieren, Gel und Membran horizontal zwischen zwei Plattenelektroden angeordnet. Die Filterpapiere werden mit einer Pufferlösung (meist weniger als 100ml) getränkt und mit dem Gel und der Membran auf die Anode geschichtet. Durch den geringen Abstand der Elektroden kann ein relativ starkes und homogenes elektrisches Feld generiertwerden, was wiederum die Transferzeit verkürzt und keine Kühlung erfordert.